Резюме. Цель исследования: определение качественного и количественного состава пародонтопатогенов в пародонтальных карманах у больных с агрессивным пародонтитом.
Особенности микрофлоры пародонтальные карманов при агрессивных формах пародонтита
2009
E.A. Tarasova,
M.A. Suvorova,
A.V. Svarval,
R.S. Ferman,
A.B. Zhebrun,
A.N. Suvorov (St.Petersburg, RU)
Обследованы больные с диагнозом агрессивный (30) и хронический (20) пародонтит. Проведено клиническое и рентгенологическое обследование, определение индекса гигиены полости рта (OHI-S; Greene& Vermillion, 1964), измерение глубины пародонтального кармана (ПК), потери зубодесневого прикрепления (ПЗП) и молекулярно-биологическое исследование пародонтопатогенов с помощью ПЦР в реальном времени (PCR Real-time).
Заключение: качественный и количественный состав пародонтопатогенов в пародонтальных карманах отличается при разных формах агрессивного пародонтита, а также в сравнительной оценке между агрессивным и хроническим пародонтитом.
Агрессивный пародонтит, ПЦР в реальном времени. Characteristics of periodontal pocket microorganisms in aggressive periodontitis (A.V.Tsimbalistov, T.T.Natsvlishvili, T.I.Kadurina, G.B.Shtorina, M.A.Suvorova, E.A.Tarasova). Summary. Objective: The aim of the study is to determine the composition and quantity periodontal patogenes in periodontal pockets of patients with aggressive periodontitis. Materials and methods: The study included patients with aggressive and chronic periodontitis. Clinical evaluation included assessment of the oral hygiene index (OHI-S; Greene & Vermillion, 1964), the periodontal pocket depth and the attachment loss. The patients were examined radiographycaly and periodontalpathogenes were detected using real-time PCR. Conclusion: The composition and number of periodontal patogenes in periodontal pockets differ both in different forms of aggressive periodontitis, and between aggressive and chronic periodontitis.
Aggressive periodontitis, real-time PCR. Хронический пародонтит – это заболевание, характеризующееся нормальным иммунным ответом на хроническую бактериальную инфекцию [5], который, с одной стороны, удаляет повреждающий фактор, а с другой стороны, ремоделирует подлежащую соединительную костную ткань, приводя к деструкции пародонтальных тканей. Хронический пародонтит, как правило, развивается у людей старше 40 лет. Скорость резорбции костной ткани в 81% случаев достигает, в среднем, 0,05-0,5 мм в год [9], зависит от качества гигиены полости рта, количества зубных отложений, местных и системных факторов риска, курения, стресса [8]. Однако в ряде случаев хронический воспалительный процесс в пародонте развивается очень быстро, скорость резорбции костной ткани достигает 1,08-1,8 мм в год [9], поражает молодых (от 17 до 35 лет) и практически здоровых людей, хотя существует мнение, что данная патология может развиться в любом возрасте [8]. Эту группу заболеваний пародонта называют агрессивными формами пародонтита.
Доказано, что основным этиологическим фактором для всех форм пародонтита являются микроорганизмы зубного налета [ 1,3,4]. Особый интерес для многих исследователей представляет изучение микрофлоры пародонтальных карманов у больных с агрессивным пародонтитом в связи с атипичным течением процесса. В полости рта здорового человека присутствует около 700 штаммов различных микроорганизмов. Их количество в зубодесневой борозде колеблется от 103 — в условиях здорового пародонта до 10s — в глубоких пародонтальных карманах. Большинство исследований о составе микрофлоры пародонтальных карманов у больных с агрессивными формами пародонтита посвящено изучению его локализованных форм [8]. Установлено [6], что ведущая роль в этиологии локализованного агрессивного пародонтита (ЛАП) принадлежит бактерии Aggregatibacter actinomycetemcomitans (ранее: Actinobacllus actinomycetemcomitans). По сравнению с бактериологическими исследованиями ЛАП, в литературе мало данных о составе микрофлоры пародонтальных карманов у больных с генерализованным агрессивным пародонтитом (ГАП). Мнение о том, что в патогенезе ГАП играют Aggregatibacter actinomycetemcomitans и Porphyromonas gingivalis (American Academy of Periodontology, 2000), изменилось с накоплением данных молекулярно-бактериологических исследований. Высказывается мнение [8], что именно Porphyromonas gingivalis и Tannerella forsythensis (ранее: Bacteroides forsythus) и в меньшей степени A. actinomycetemcomitans принадлежит ведущая роль в генезе ГАП. Однако В. Riep с соавт. (2009) считают, что ведущая роль в развитии ГАП принадлежит Treponema lecithinolyticum. В связи с отсутствием единого мнения исследователей об этиологии агрессивных форм пародонтита и с недостаточностью данных, исследование микрофлоры пародонтальных карманов является актуальной проблемой.
Определение качественного и количественного состава пародонтопатогенов в пародонтальных карманах у больных с агрессивным пародонтитом.
Обследовано 30 больных в возрасте от 20 до 35 лет (10 мужчин и 20 женщин) с диагнозом агрессивный пародонтит и 20 больных в возрасте от 35 до 50 лет (8 мужчин и 12 женщин) с диагнозом хронический генерализованный пародонтит. Проведены исследования: клиническое и рентгенологическое обследование больных; определение индекса гигиены полости рта (OHI-S; Greene&Vermillion, 1964); измерение глубины пародонтального кармана (ПК), т.е. расстояния между краем десны и клинически зондируемым дном пародонтального кармана или десневой борозды, потери зубодесневого прикрепления (ПЗП) — расстояние между цементо-эмалевой границы зуба и клинически зондируемым дном пародонтального кармана или десневой борозды; молекулярно-биологическое исследование пародонтопатогенов с помощью ПЦР в реальном времени (PCR Real-time).
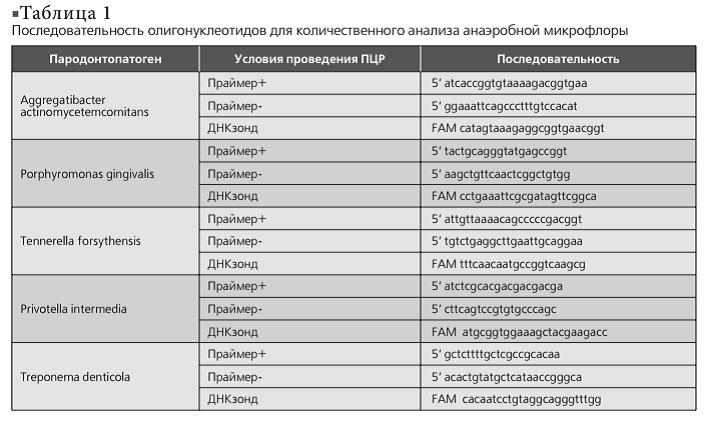
Методика проведения ПЦР в реальном времени (PCR Real-time) Материал из зубодесневых карманов собирали в пробирку с транспортной средой при помощи специальных зондов (бумажные штифты). Из собранного материала выделяли тотальную ДНК с помощью набора для выделения ДНК "ДНК-сорб В" (АмплиСенс, Россия) согласно инструкциям производителя. Для количественного анализа анаэробной микрофлоры рта использовали метод ПЦР в реальном времени со специфическими праймерами и Taqman-зондами. Последовательность всех олигонуклеотидов приведена ниже в табл. 1. Реакция ПЦР была выполнена в буфере, содержащем 67 мМ Трис-HCl (рН 8,3), 17 мМ (NH4)2S04, 2,5 мМ MgCl2, 0,1% Tween-20, 0,12 мкг БСА, 8% глицерола, с 200 мкМ каждого дезокситрифосфата, 15 пмоль каждого праймера и зонда, 2,5 U Taq ДНК-полимеразы (Силекс, Россия). В качестве матрицы использовали 5 мкл выделенного образца ДНК. Амплификация ДНК была выполнена на приборе MiniOpticon (Biorad, США) по программе: первичная денатурация при 94°С — 2 минуты, последующая амплификация в течение 45 циклов при 94°С — 30 секунд, 60°С — 30 секунд, 72°С — 30 секунд. Количественная оценка осуществлялась путём сравнения кинетики накопления сигнала в исследуемых образцах с кинетикой накопления сигнала в стандартных калибровочных образцах с известным количеством ДНК-мишени.
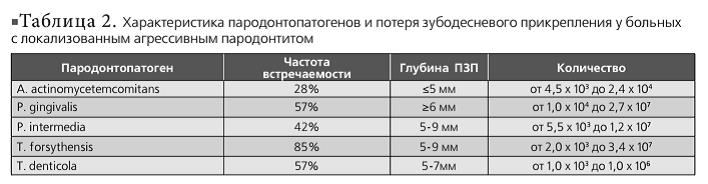
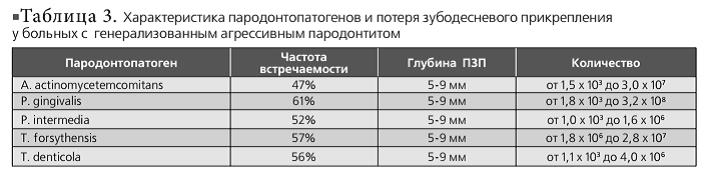
По данным клинико-рентгенологического обследования пациентов с агрессивным пародонтитом локализованная форма диагностирована у 7, генерализованная – у 23 больных. 57% из больных емых бактерий и глубина ПЗП у больных с ГАП приведены в табл. 3.
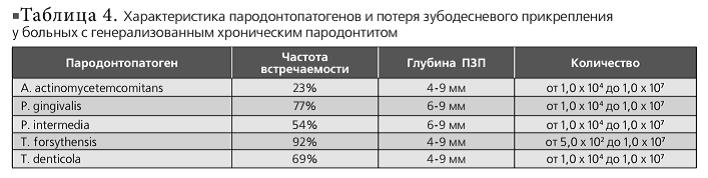
По результатам обследования больных с хроническим генерализованным пародонтитом в 70% случаев индивидуальная гигиена полости рта удовлетворительная (OHI-S 6 мм. Особенности состава и количества пародонтопатогенов у больных с генерализованным хроническим пародонтитом представлены в табл. 4.
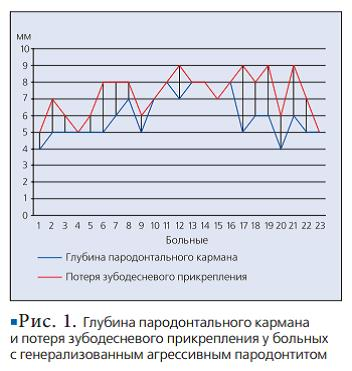
Тяжесть течения агрессивных форм пародонтита, особенности возрастной группы больных и характер клинических проявлений обусловливают особый интерес исследователей и клиницистов. Выбор такого метода клинического обследования тканей пародонта, как определение потери зубодесневого прикрепления (ПЗП) обусловлен тем, что он более информативен при определении степени деструкции пародонтальных тканей. Наше исследование показало разницу между значениями глубины пародонтального кармана и потери зубодесневого прикрепления у больных с агрессивным пародонтитом, которая составляет от 1 до 4 мм. Оценка объема деструкции пародонтальных тканей важна при установлении тяжести пародонтита и выборе тактики лечения. Использование метода ПЦР в реальном времени в нашем исследовании основано на необходимости применения простого, чувствительного, специфичного способа выявления некультивируемых микроорганизмов в короткие сроки. Высокая специфичность метода ПЦР обусловлена тем, что в исследуемом материале выявляется уникальный, характерный только для данного возбудителя фрагмент ДНК. Высокая чувствительность ПЦР в идеальных условиях позволяет выявить даже единичные клетки бактерий, т.е. дает возможность обнаружить наличие возбудителей инфекционных заболеваний, когда другие методы (иммунологические, бактериологические, микроскопические) не работают. Преимуществом метода ПЦР в реальном времени является возможность количественной оценки микрофлоры [2].
По данным нашего исследования, ЛАП чаще встречается у молодых до 30 лет и проявляется средней степенью тяжести пародонтита, несмотря на удовлетворительную гигиену полости рта больных. A. actinomycetemcomitans определяется реже (28%), чем P. gingivalis (57%) и Т. forsythensis (85%), при глубине ПЗП не более 5 мм и в небольшом количестве (от 4,5 х 10* до 2,4 х 10*). Последние две выявляются в глубоких пародонтальных карманах и в большом количестве (P. gingivalis — от 1,0 х 104 до 2,7 х 107; Т. forsythensis — от 2,0 х 103 до 3,4 х 107), так как они являются облигатными анаэробами. Генерализованной формой агрессивного пародонтита чаще болеют люди старше 30 лет. A. actinomycetemcomitans определяется в большом количестве (от 1,5 х 103 до 3,0 х 107) при потере зубодесневого прикрепления от 5 до 9 мм. Но чаще этого микроорганизма выявляются P. gingivalis (61%) (от 1,8 х 103 до 3,2 х 108) и Т. forsythensis (57%) (от 1,8 х 106 до 2,8 х 107). По сравнению с результатами исследования ПЦР в реальном времени пародонтопатогенов у больных с агрессивными формами пародонтита, больные с хроническим генерализованным пародонтитом реже имеют в составе микрофлоры пародонтального кармана A. actinomycetemcomitans (23%), но чаще — Т. forsythensis (92%), P. gingivalis (77%) и Т. denticola (69%). По-видимому, A. Actinomycetemcomitans запускает процесс воспаления в пародонте, так как этот возбудитель выявляется чаще при неглубоких пародонтальных карманах, а за дальнейшее прогрессирование деструктивного процесса отвечают Tannerella forsythensys и Porphyromonas gingivalis. Количества этих пародонтопатогенов меньше при хроническом пародонтите (<1,0 х 107), по сравнению с агрессивными формами (3,2 х 10е), что совпадает с данными зарубежных исследований. Исходя из вышеизложенного, как состав, так и количество пародонтопатогенов в пародонтальных карманах отличаются как при разных формах агрессивного пародонтита, так и между агрессивным и хроническим пародонтитом.

